Il chimica È la scienza che studia la composizione e le trasformazioni che possono avvenire nella materia, in ogni sua forma. Una delle aree di studio più importanti in chimica è quella di gas, poiché è necessario effettuare un'analisi del loro comportamento sulla Terra.
I gas, così come è inteso in tutta la disciplina, dovrebbero essere spiegati mediante equazioni e altri elementi matematici e statistici, che comunque differiscono a seconda del tipo di gas e delle condizioni attorno ad esso. A causa della complessità di questi calcoli, il chimico Jan van Helmont (lo stesso che ha coniato il concetto di gas) ha redatto una famosa Legge, che generalizza una tendenza al comportamento dei gas, nella sua relazione tra energia cinetica e temperatura.
Il Legge di Van HelmontNella sua versione più semplice, indica che a temperatura costante il volume di una massa fissa di gas è inversamente proporzionale alla pressione che esercita: P * V = k costante. Tuttavia, come ogni contributo scientifico, deve poter essere raccolto e garantita la sua affidabilità, che si è riscontrata non in tutti i casi.
La conclusione raggiunta è che non è che la Legge fosse sbagliata, ma quello ha funzionato solo per un gas teorico, un'assunzione di gas in cui le molecole non collassano tra di loro, ha sempre lo stesso numero di molecole che occupano lo stesso volume alle stesse condizioni di pressione e temperatura, e non ha forze di attrazione o repulsione.
Il gas ideale, nonostante non rappresenti un gas realmente esistente, è un strumento per facilitare un gran numero di calcoli matematici.
Il equazione generale dei gas idealiInoltre, risulta dalla combinazione di altre due leggi fondamentali per la chimica, che presuppone anche che i gas siano conformi alle caratteristiche dei gas ideali. La legge di Boyle-Mariotte mette in relazione il volume e la pressione di una quantità di gas a temperatura costante, visto che sono inversamente proporzionali. La Legge di Charles - Gay Lussac mette in relazione il volume e la temperatura, visto che sono direttamente proporzionali alla pressione costante.
Non è possibile creare un file elenco concreto dei gas ideali, perché come detto è un pezzo unico gas ipotetico. Se puoi elencare un insieme di gas (compresi i gas nobili) il cui trattamento può essere identico a quello dei gas ideali, perché le caratteristiche sono simili, purché le condizioni di pressione e temperatura siano normali.
- Azoto
- Ossigeno
- Idrogeno
- Diossido di carbonio
- Elio
- Neon
- Argon
- Krypton
- Xeno
- Radon
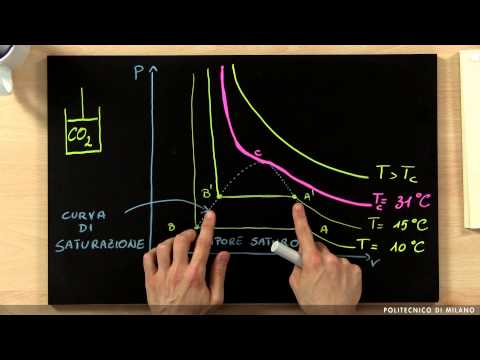
Il gas reali sono, in opposizione agli ideali, quelli che hanno un comportamento termodinamico e quindi non seguono la stessa equazione di stato dei gas ideali. In alta pressione e bassa temperatura, i gas devono inevitabilmente essere considerati reali. In tal caso si dice che il gas si trovi in una condizione di alta densità.
Il differenza sostanziale tra gas ideale e gas reale è che quest'ultimo non può essere compresso indefinitamente, ma la sua capacità di compressione è relativa ai livelli di pressione e temperatura.
Il gas reali hanno anche un'equazione di stato che descrive il loro comportamento, che è quella fornita da Van der waals nel 1873. L'equazione ha una fattibilità abbastanza alta in condizioni di bassa pressione e modifica l'equazione del gas ideale in una certa misura: P * V = n * R * T, dove n è il numero di moli del gas, e R una costante chiamata 'costante dei gas'.
I gas che non si comportano in modo simile ai gas ideali sono chiamati gas reali. Il seguente elenco mostra alcuni esempi di questi gas, sebbene possano essere aggiunti anche quelli che sono già stati elencati come gas ideali, ma questa volta in un contesto di alta pressione e / o bassa temperatura.
- Ammoniaca
- Metano
- Etano
- Ethene
- Propano
- Butano
- Pentano
- Benzene