Contenuto
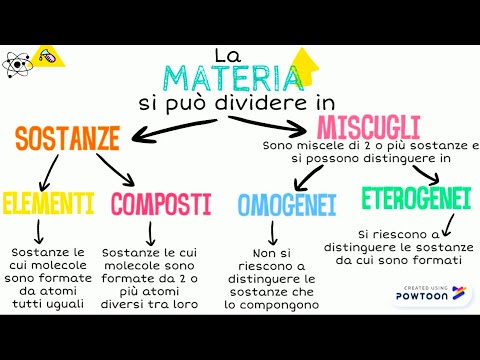
Tutti i importa che conosciamo dell'universo può essere classificato in base alla sua costituzione in due categorie: sostanze pure e miscele.
Ilsostanze pure sono quelli che sono costituiti, in linea di principio, da un unico elemento chimico oppure dagli elementi di base che ne costituiscono la struttura molecolare, nel caso in cui sia a composto.
Una sostanza pura conserva sempre le stesse proprietà fisiche e chimiche, quindi risponde sempre allo stesso modo a un dato stimolo o reazione, come il punto di bollente onda densità.
Le sostanze pure, quindi, possono essere monoatomiche (come l'elio puro), chiamate anche sostanze semplici perché non possono essere suddivise nei loro componenti; o sostanze composte (come l'acqua: idrogeno + ossigeno), poiché comprendono una proporzione fissa e stabile degli elementi di base che la compongono.
Naturalmente, una sostanza pura mancherà sempre di additivi aggiuntivi o qualsiasi tipo di contaminante che altera la sua struttura fondamentale.
Esempi di sostanze pure
- Elio puro. Contenuto in stato gassoso nel riempimento di palloncini di partito, o tra i componenti delle reazioni nucleari dell'idrogeno, poiché è a gas nobile, cioè un gas a bassissima reattività e che quindi normalmente non si combina con altre sostanze per formare nuove strutture chimiche.
- Acqua pura. Spesso indicato come acqua distillato, è ottenuto attraverso processi di laboratorio per evitare di diluire qualsiasi altra sostanza ambientale (poiché l'acqua è il più grande solvente conosciuto). Si tratta quindi di acqua composta esclusivamente da atomi di idrogeno e ossigeno (H.2O), niente di più.
- Oro zecchino. L'oro puro, 24 carati, è un blocco elementare unico, composto solo ed esclusivamente da atomi di oro (Au).
- I diamanti. Anche se può non sembrare, i diamanti, uno dei materiali più duri conosciuti, sono costituiti atomi di solo carbonio (C), disposti in modo così particolare che i loro legami sono quasi indistruttibili.
- Zolfo. Questo elemento della tavola periodica si trova in molte sostanze semplici o composte, poiché è un elemento molto reattivo. Quindi, possiamo nominare il file acido solforico (H2SW4) come sostanza pura, nonostante contenga atomi di idrogeno, zolfo e ossigeno, poiché si comportano come una ed unica sostanza.
- Ozono. Un composto di raro aspetto nel nostro ambiente quotidiano, ma abbondante nelle pressioni e temperature dell'atmosfera alta, è l'ozono. Consiste in un file molecola simile all'ossigeno, ma con tre atomi di questo elemento (O3) ed è spesso utilizzato proprio per purificare l'acqua.
- Benzene (C6H6). UN idrocarburo, cioè un'unione di atomi di carbonio e idrogeno, incolore, inodore, infiammabile e tossico, ma ottenibile in uno stato di purezza, preservandone le proprietà e le reazioni.
- Cloruro di sodio (NaCl). Il sale comune, quello che abbiamo a casa, è una sostanza composta pura. È composto da due elementi: cloro e sodio. Quando invece lo aggiungeremo alla zuppa, farà parte di una miscela piuttosto complessa.
- Anidride carbonica (CO2). Il gas che espelliamo dopo aver respirato e che le piante richiedono per il loro lavoro di fotosintesi. Composto da carbonio e ossigeno, viene solitamente disciolto (miscelato) nell'atmosfera insieme ad altri gas, ma quando viene prelevato dalle piante o prodotto in laboratorio, è allo stato puro.
- Grafite. Un'altra delle apparenze pure del carbonio, simile al diamante chimicamente, sebbene non così fisicamente. È costituito solo da atomi di carbonio, in un allineamento molecolare molto più debole e malleabile rispetto ai diamanti.
Miscele
Il miscele sono la combinazione di due o più sostanze pure, in proporzioni variabili e che ne conservano molte proprietà individuo, ottenendo così una sostanza mista i cui componenti possono essere scissi con metodi fisici e / o chimici.
A seconda della modalità di interazione di questi componenti, le miscele possono essere di due tipi:
- Miscele eterogenee. In essi si può osservare la presenza degli elementi misti, sia ad occhio nudo che con apparecchiature di laboratorio, poiché distribuiti in modo irregolare, oppure in fasi distinguibili. Queste miscele possono essere, a loro volta, sospensioni (particelle fisiche osservabili nel solvente) o colloidi (Le particelle fisiche sono così minuscole da non essere facilmente osservabili e sono in costante movimento e collisione).
- Miscele omogenee. Gli elementi che compongono queste miscele sono distribuiti in modo molto uniforme e non possono essere individuati ad occhio nudo. Sono spesso chiamati soluzioni chimiche O semplicemente soluzioni, poiché i suoi componenti (soluto Y solvente) non sono facilmente separabili.
Soluto e solvente
Il soluzioni sono miscele omogenee, cioè indiscernibili; ma i suoi componenti sono chiamati soluto Y solvente secondo la proporzione maggioritaria del secondo rispetto al primo.
Per esempio:
Se in un file liquido Pochi grammi di solido B, possono dissolversi e non possiamo vederli ad occhio nudo, come possiamo ancora fare con il liquido che li contiene. Tuttavia, se evaporiamo questo liquido, i grammi del solido rimarranno nel contenitore che conteneva la soluzione. Questi tipi di processi sono chiamati metodi di separazione della materia.
Esempi di miscele
- Gelatina. Questa miscela colloidale di collageni da materia cartilaginea animale è composta mescolando acqua e un solido in presenza di calore. Una volta ottenuta una miscela uniforme (omogenea), si raffredda solidificare e ottieni il solito dolce per bambini.
- Fumi della cucina. Solitamente una miscela di propano e butano, i gas che utilizziamo per accendere la stufa o il forno non sono distinguibili (miscela omogenea) e condividono il loro punto di accensione, ma potrebbero essere perfettamente separati in laboratorio sfruttando alcune differenze chimiche o fisiche tra i due.
- Aria ambiente. Chiamiamo aria una miscela indiscernibile di gas, che include molti monoatomici (ossigeno, idrogeno, ecc.) E altri composti. Sebbene a prima vista non siano distinguibili, è possibile separarli in laboratorio e ottenerli ciascuno allo stato puro.
- Acqua di mare. L'acqua di mare è tutt'altro che pura: contiene esci, sostanze composte prodotto di processi chimici, residui chimici di vita o attività umane, insomma è una miscela più o meno uniforme dei suoi componenti. Tuttavia, se mettiamo l'acqua di mare ad asciugare al sole, otterremo il sale sul fondo del contenitore mentre il liquido evapora.
- Il sangue. Infinite sostanze organiche si dissolvono nel sangue, cellule, enzimi, proteina, nutrienti e gas come l'ossigeno. Tuttavia, in una goccia non possiamo discernere nulla, a meno che non lo vediamo al microscopio.
- La Mayo. La maionese è una salsa emulsionata a freddo, una miscela di uova e olio vegetale, nessuno dei quali è, a sua volta, una sostanza pura. Quindi è una miscela molto complessa di sostanze complesse in cui è impossibile discernere i suoi componenti.
- Zucchero in un bicchiere d'acqua. In linea di principio, lo zucchero è solubile in acqua, quindi possiamo perdere di vista i suoi cristalli mentre li versiamo nel bicchiere e mescoliamo con un cucchiaino. Tuttavia, se continuiamo ad aggiungere (saturando la soluzione), raggiungeremo un intervallo di concentrazione tale che lo zucchero in eccesso rimanga sul fondo, cioè non formi più miscela.
- Acqua sporca L'acqua contaminata dal suolo o da altre sostanze di rifiuto consente ad occhio nudo di vedere molti dei soluti che ne offuscano la trasparenza. Questi elementi sono in sospensione nel liquido, quindi possono essere rimossi mediante a processo di filtraggio.
- Il bronzo. Come tutte le leghe, il bronzo è l'unione di due metalli diversi, come il rame e lo stagno (sostanze pure). Ciò consente la costruzione di parti metalliche non troppo stabili, poiché i loro atomi non costruiscono legami permanenti, e quindi malleabili e duttili, ma resistenti. L'invenzione del bronzo è stata una vera rivoluzione per l'umanità antica.
- Riso con fagioli. Per quanto li mescoliamo nel piatto o nella pentola, i fagioli e il riso saranno distinguibili ad occhio nudo, anche se li mangiamo insieme per goderci il loro sapore combinato. Questo è un vero buffet e perfettamente siftable, se volessimo separarli del tutto.
Ti posso servire
- Esempi di miscele
- Esempi di miscele omogenee ed eterogenee
- Esempi di chimica nella vita quotidiana